Aplicaciones De La Ley De Avogadro
M a O 16 uma. Ley de Dalton y sus aplicaciones.

Quimica Ley De Avogadro Traful Utemvirtual Youtube
Esta ley descubierta por Avogadro a principios del siglo XIX establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión.

Aplicaciones de la ley de avogadro. B- Hallar la cantidad de átomos de hidrógeno en esa misma cantidad 35 mL c- Hallar la cantidad de átomos de oxígeno en esa cantidad 35 mL DATOS. Por tanto es el factor proporcional que relaciona la masa molar de una sustancia la masa de una muestra. La ley de Avogadro puede enunciarse como sigue.
En 1811 enunció el conocido principio o ley de Avogadro basado en la teoría atómica de John Dalton y la ley de Gay-Lussac sobre los vectores de movimiento en la. A ley de Dalton se puede referir a 2 resultados importantes en química formulados por John Dalton. 2 2 2 2 2 198 1 44 045 045 224 1 100 gCO molCO gCO mol mol L molCO LCO En condiciones normales 1 mol de cualquier gas ocupa un volumen de 224 L posteriormente utilizando la masa molar del CO 2.
INTERESA RECORDAR LA LEY DE AVOGADRO. Resultados de la experimentación han determinado que bajo condiciones normales de presión y temperatura 273 K y 760 mm Hg el volumen molar de un gas es. Principios de los gases Ley de Avogadro Descubierta por Avogadro a principios del siglo XIX esta ley establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión.
Ley de AvogadroArtículo principal. Si aumentamos la cantidad de gas aumentará el volumen. About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy Safety How YouTube works Test new features Press Copyright Contact us Creators.
Recuerda que la cantidad de gas la medimos en moles. La hipótesis y la ley de Avogadro describen la relación entre los moles de un gas y el volumen del mismo. Asegura que en un proceso a presión y temperaturaconstante isobaro e isotermo el volumen de cualquier gas es proporcional al número demoles presente de tal modo queLey de.
Sin embargo la importancia y trascendencia de esta hipótesis fue poco apreciada y conocida por los científicos contemporáneos durante medio siglo hasta que en 1858 la resaltó Cannizzaro. ESTADO GASEOSO Las investigaciones sobre gases fueron fundamentales en el conocimiento de la estructura intensa de la materia. Ley de AvogadroLa Ley de Avogadro fue expuesta por Amedeo Avogadro en 1811 y complementaba a lasde Boyle Charles y Gay-Lussac.
Principios de los gases y aplicaciones. Ley de las presiones parciales Annotations. Ya que la ley de avogadro sugiere una relación entre los volúmenes cantidades de gas a presión y temperaturas constantes se tiene que una de sus posibles aplicaciones a la vida cotidiana entraría en el llenado de un globo infantil al suministrar gas dentro del material este se expande lo cual a su vez permite el aumento de volumen de igual forma al dejar escapar un poco el gas el material.
De manera matemática puede expresarse como. Adquirir conocimientos básicos de la leyes de Avogadro que permitan al alumno analizar y aplicar cada una de ellas desarrollar habilidades para el análisis y resolución de problemas que involucran la aplicación de dichas leyes en la vida cotidiana. VOLVER AL ENUNCIADO DE ÉSTE Y DE OTROS EJERCICIOS RELACIONADOS CON LA LEY DE AVOGADRO.
Su valor es igual a 6022 140 857 10 23 mol 1. A temperatura y presión constantes el volumen V que ocupa una cantidad determinada de gas es directamente proporcional a los moles n de gas. V i Volumen del gas n i Número de moles k Una constante de proporcionalidad.
Ejercicio amedeo avogadro introducción ley de avogadro conclusión ley de avogadro en este trabajo hablaremos sobre la ley de avogadro y resolveremos los problemas planteados Un globo de helio se infla hasta tener un volumen de 2 litros el helio es un gas muy ligero asi que poco. El principio de Avogadro. La constante de Avogadro o número de Avogadro es el número de partículas constituyentes que se encuentran en la cantidad de sustancia de un mol.
M a H 1 uma. El cálculo de las presiones parciales de una mezcla de gases aplicando la ley de. La ley de Avogadro permitía la determinación del peso relativo de moléculas y átomos.
Científico francés para descubrir la ley de conservación de la masa estudió la reacción entre hidrógeno y oxígeno en fase gaseosa para sintetizar el agua. Ley de Avogadro Desarrollados 1- Cuál es la masa de 100 L de CO 2 en condiciones normales de presión y temperatura CN.

Quimicas Ley De Avogadro De Los Gases Ley De Avogadro El Gas Ensenanza De Quimica

Ley De Avogadro Wikipedia La Enciclopedia Libre
Http Catalinaartunduagasar Blogspot Com 2016 03 Gases En La Cotidianidad Html

Ley De Avogadro Ley De Avogadro Ensenanza De Quimica El Gas
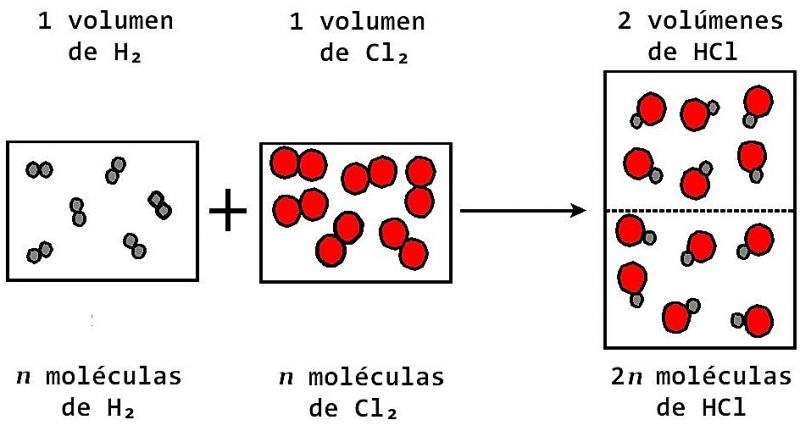
Ley De Avogadro Que Es En Que Consiste Enunciado Formula Aplicaciones
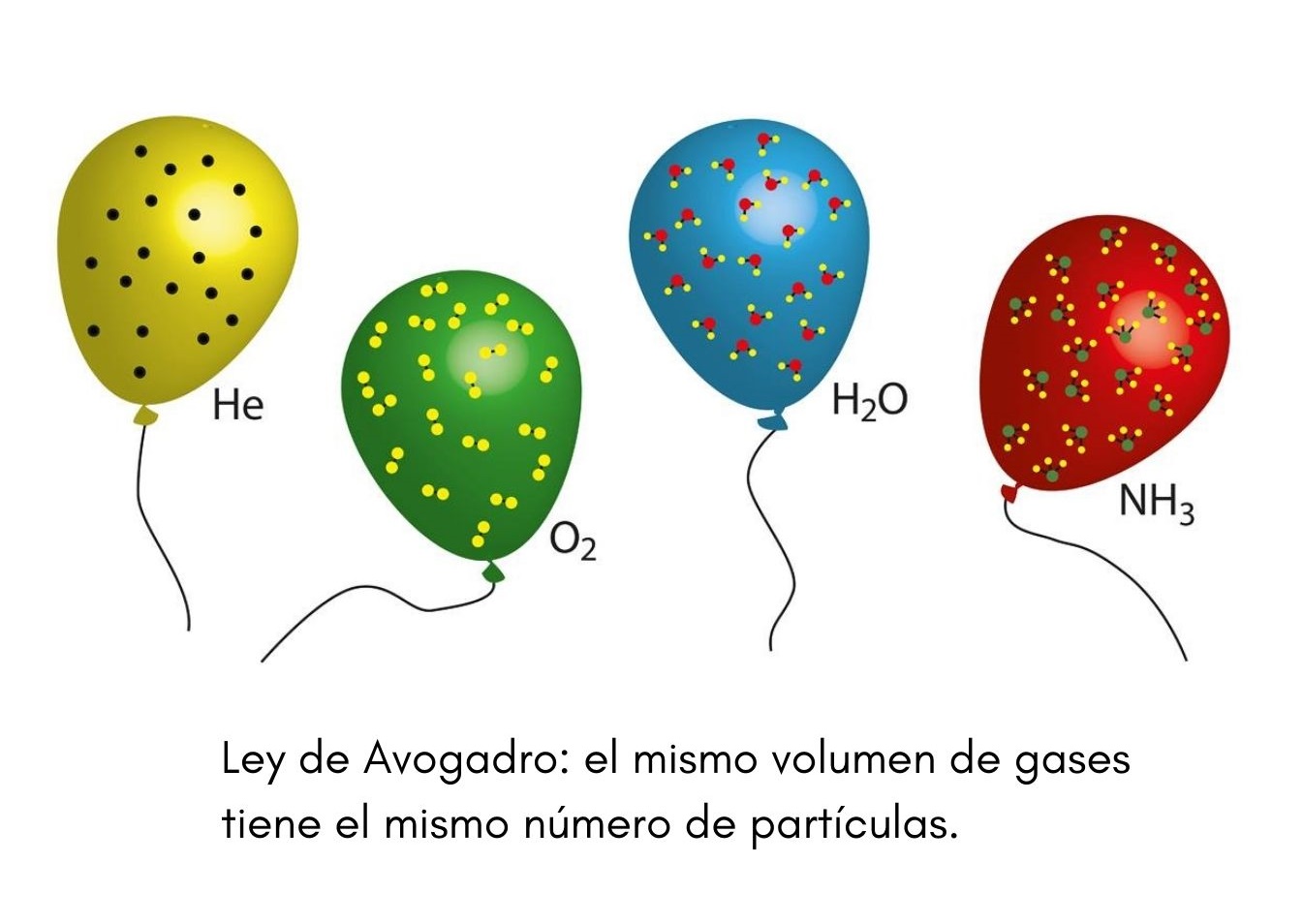
Ley De Avogadro Que Es Formula Condiciones Importancia Ejemplos

Ley De Avogadro Ley De Avogadro Ensenanza De Quimica El Gas

Ley De Avogadro Y Su Importancia Docsity

Quimicas Ejemplos De La Ley De Graham

Ley De Avogadro De Los Gases Quimica Wikisabio
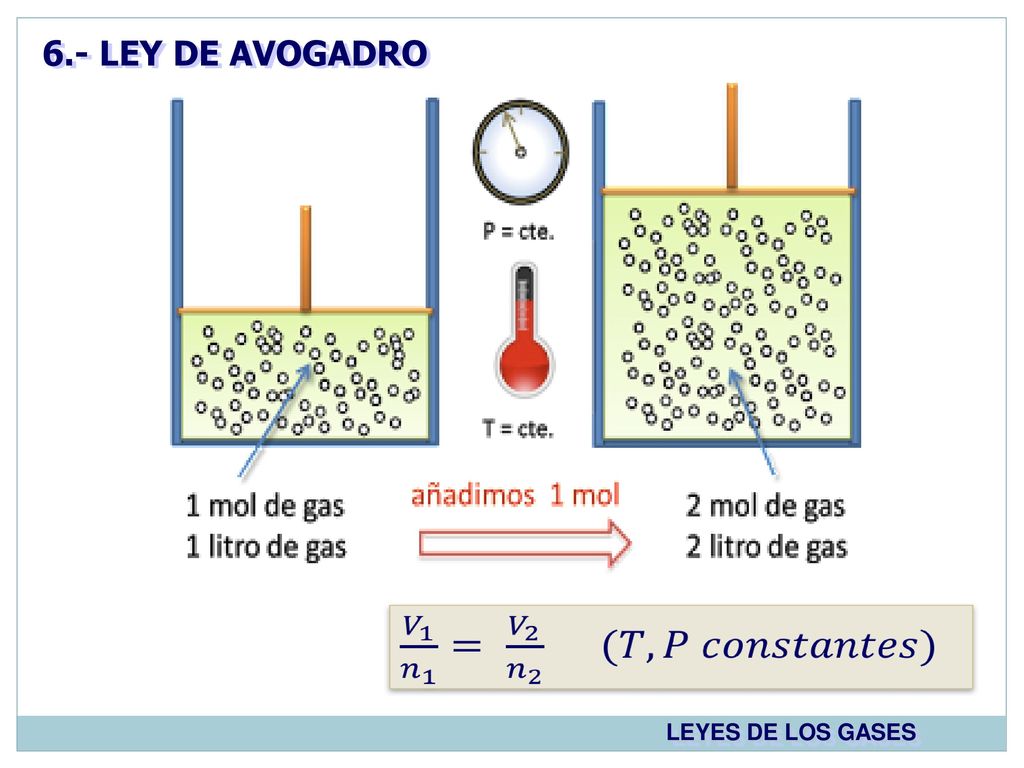
Ley De Avogadro Ejemplos Cotidianos

Quimicas Ley De Avogadro De Los Gases

Ley De Avogadro Leyes De Los Gases Ideales Ejercicio Resuelto Youtube


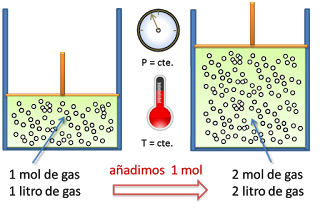






Posting Komentar untuk "Aplicaciones De La Ley De Avogadro"