Modelo De Bohr Del Calcio
Como indicador de anomalía del Sistema Solar debido a su capacidad de desintegración en 41K. La ditancia de la órbita al núcleo se determina según el número cuántico n n.

Tomi Digital Modelo Atomico De Bohr
Modelo de bohr del calcio El físico danés Niels Bohr realizó una serie de estudios de los que dedujo que los electrones de la corteza giran alrededor del núcleo describiendo sólo determinadas órbitas circulares.

Modelo de bohr del calcio. Su masa atómica es 40078 u. Modelo de Bohr Ejercicio Suscríbete a nuestro canal en Youtube para ayudarnos a seguir creciendo httpbitly176oxcX Academia Usero en Estepona el centro. Distribución electrónica según modelo de Bohr K 1 11p N-17 Sodio Na 11e- n A-Z L 2 n23-11 M 3 n17 N 4 O 5 P 6 Q 7 K L M 2 8 1 Calcio Ca Masa atómica A40 Número atómico Z20 Número de neutrones N20 20 20-1 2 3 4 periodo.
4 K2e- L8e- M8e- N2e- familia. Con el modelo de Bohr se calcularon las siguientes energías para un electrón en la capa. El modelo atómico de Bohr 1 es un modelo clásico del átomo pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados.
Los electrones describen órbitas circulares estables alrededor del núcleo del átomo sin radiar energía. El Modelo Atómico de Bohr 1913 postula que. Sufren anomalías para la aplicación del modelo de Bohr pues se.
En el átomo los electrones se organizan en capas y en cada capa tendrán una cierta energía llenando siempre las capas. 34 MODELO ATÓMICO DE BOHR. Los electrones solo se pueden encontrar en ciertas órbitas no todas las órbitas están permitidas.
Este modelo planetario es un modelo funcional que no representa el átomo objeto físico en sí sino que explica su funcionamiento por medio de ecuaciones. Dado que la cuantización del momento es introducida en forma adecuada el modelo puede considerarse transaccional en cuanto a que se ubica entre la mecánica clásica y la cuántica. Niels Bohr 1885-1962 físico danés propuso dar una explicación de por qué los elementos presentaban los espectros de emisión y absorción y por qué eran diferentes unos de otros para ello retomó los trabajos de Max Planck acerca de los cuantos o fotones y de Gustav Kirckhoff quien estudió el color que emitía la flama del mechero cuando quemaba algunas sustancias.
El físico danés Niels Bohr realizó una serie de estudios de los que dedujo que los electrones de la corteza giran alrededor del núcleo describiendo sólo determinadas órbitas circulares. 24 rows Calcio Ca tiene una masa atómica de 20. Su radio medio es de 180 pm el covalente es de 174 pm y el Bohr o atómico es de 194 pm.
About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy Safety How YouTube works Test new features Press Copyright Contact us Creators. El modelo atómico de BohrModelo cuantizado del átomo propuesto en 1913 por el físico danés Niels Bohr para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos dos problemas que eran ignorados en el modelo previo de RutherfordAdemás el modelo de Bohr incorporaba ideas tomadas del. Propiedades del calcio Se le considera como un metal alcalinotérreo.
En el átomo los electrones se organizan en capas y en cada capa tendrán una cierta energía llenando siempre las capas. El modelo del hidrógeno de Bohr está basado en la suposición clásica de que los electrones viajan en capas específicas u órbitas alrededor del núcleo. Encuentra sus propiedades químicas y físicas.
Postulado I Un atomo hidrogenoide consta de un nucleo central con carga Zed onde Zes el numero at omico y de un electr on de carga egirando alrededor del nucleo en una orbita circular de radio rcon velocidad vconstante. Se encuentra en el periodo 4 y grupo 2 de la tabla periódica. Bohr explicó el espectro del hidrógeno en términos de electrones que absorben y emiten.
El modelo de Bohr se puede describir por medio de cuatro postulados. El modelo atómico de Bohr o de Bohr-Rutherford es un modelo cuantizado del átomo que Bohr propuso en 1913 para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo.
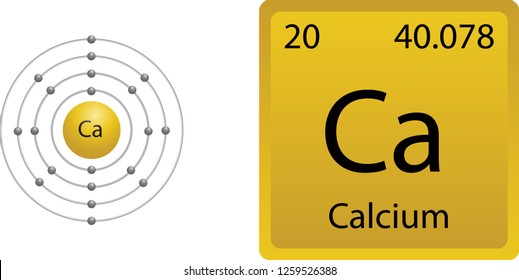
Atomo De Calcio Imagenes Fotos De Stock Y Vectores Shutterstock

Modelo De Bohr La Configuracion Electronica Atomo Imagen Png Imagen Transparente Descarga Gratuita

Archivo Capa Electronica 020 Calcio Svg Wikipedia La Enciclopedia Libre
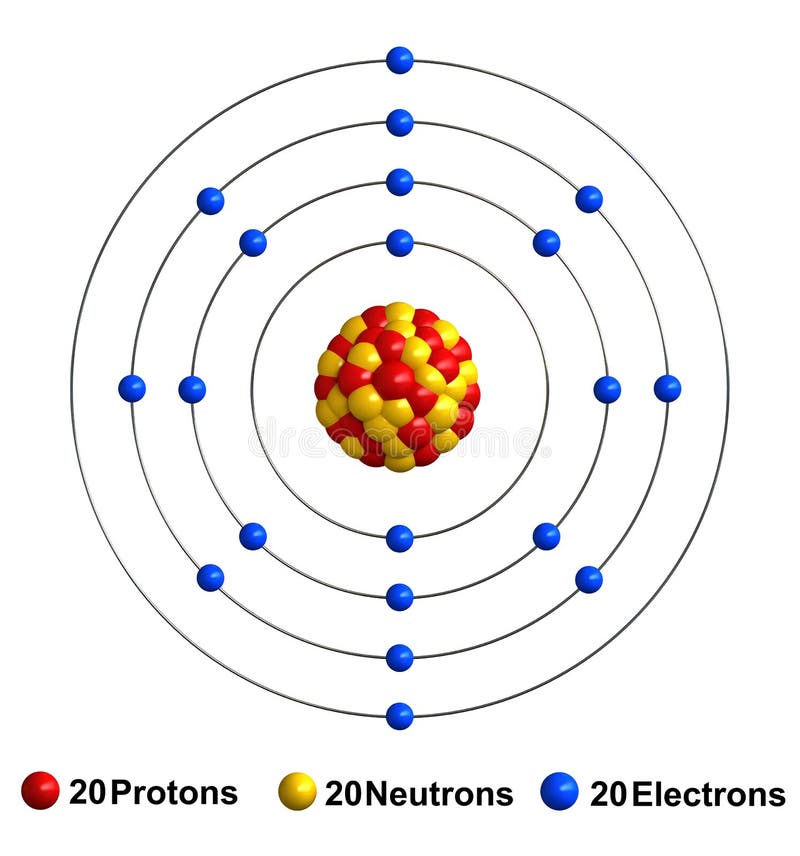
Calcium Stock Illustration Illustration Of Spheres Composition 83615456

Fisica 2 Tanit Fernandez 409 Sesion 34 Modelo Atomico De Bohr
Modelo Atomico De Bohr Explicacion Sencilla Youtube

Modelo De Bohr Descarga Gratuita De Png Espectro Electromagnetico De Radiacion Electromagnetica De Onda De La Hoja De Calculo Ola Imagen Png Imagen Transparente Descarga Gratuita
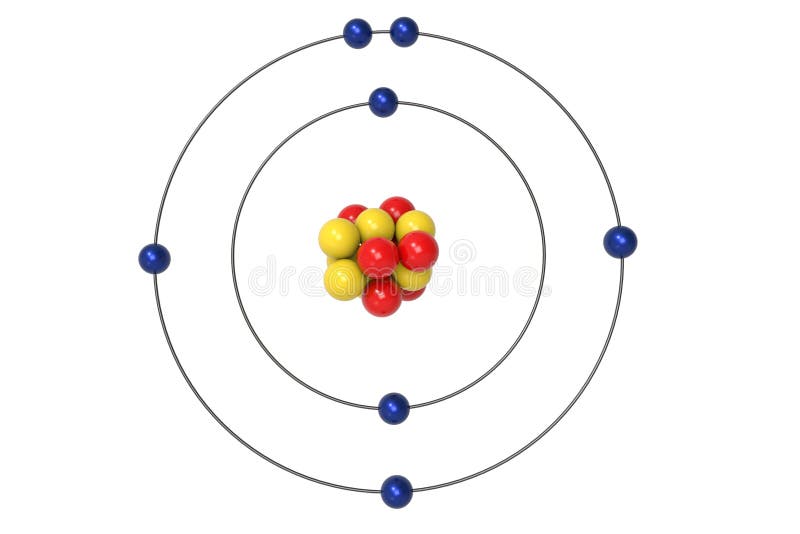
Neon Atom Bohr Model With Proton Neutron And Electron Stock Illustration Illustration Of Bohr Laboratory 111147747

Archivo Capa Electronica 020 Calcio Svg Wikipedia La Enciclopedia Libre

Modelo De Bohr Atomo La Configuracion Electronica Imagen Png Imagen Transparente Descarga Gratuita

Torio Atomo Modelo De Bohr Imagen Png Imagen Transparente Descarga Gratuita
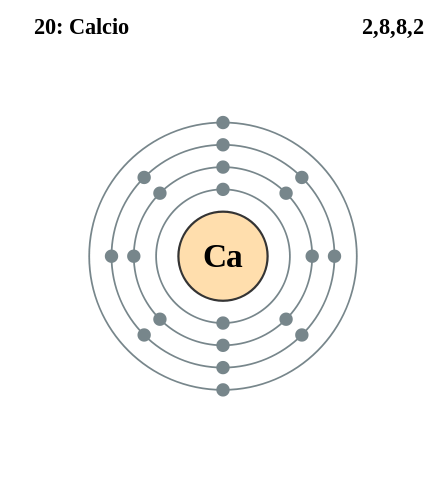
Archivo Capa Electronica 020 Calcio Svg Wikipedia La Enciclopedia Libre
Neon Atom Bohr Model With Proton Neutron And Electron Stock Illustration Illustration Of Bohr Laboratory 111147747
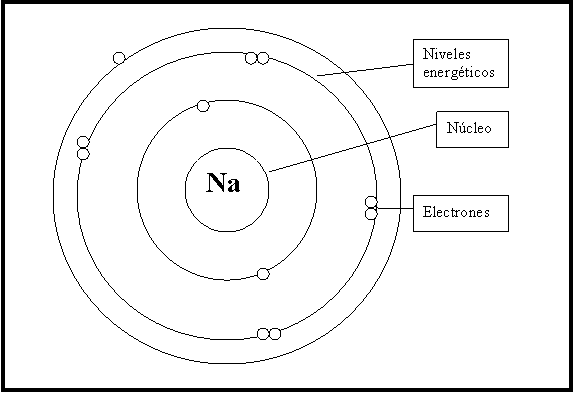
Modelo Atomico De Bohr Niveles De Energia Educ Ar
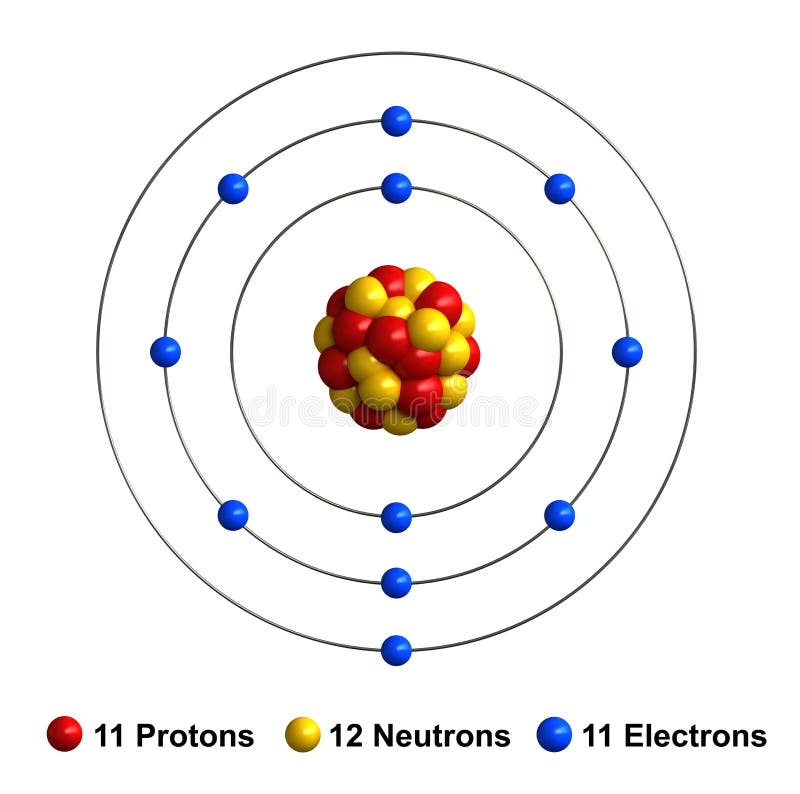
Calcium Stock Illustration Illustration Of Spheres Composition 83615456

Representa Graficamente Con Una Breve Descripcion De Los Modelos De Bohr Correspondientes A Los Brainly Com
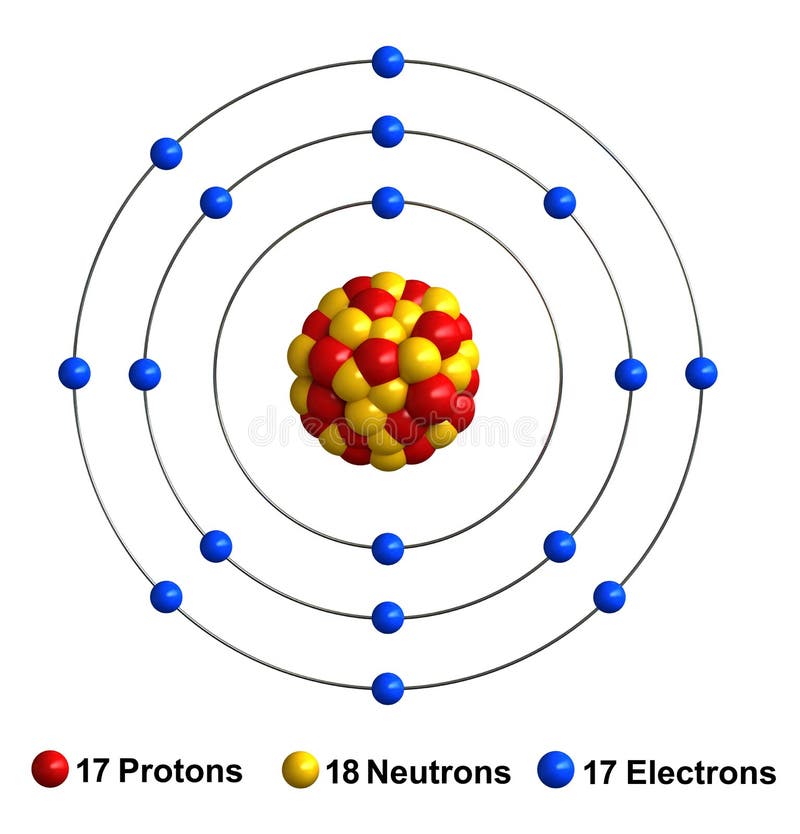
Chlorine Stock Illustration Illustration Of Isolated 83614864
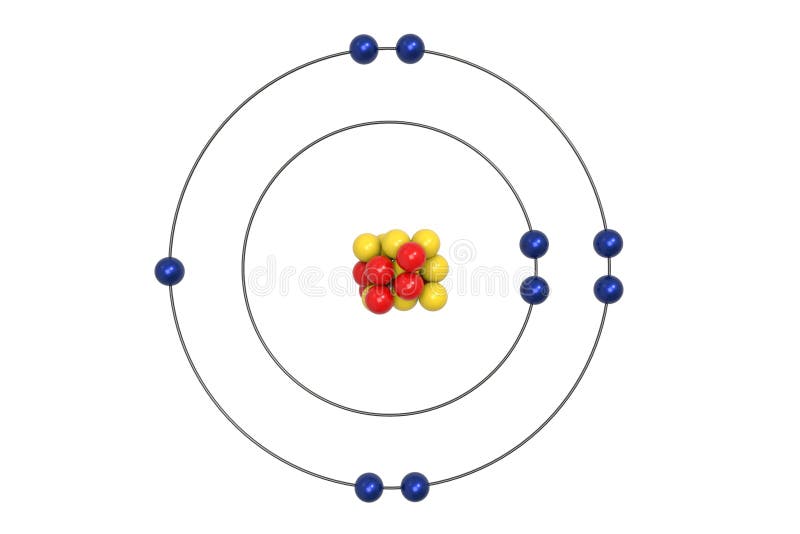
Fluorine Atom Bohr Model With Proton Neutron And Electron Stock Illustration Illustration Of Elements Core 111147701






Posting Komentar untuk "Modelo De Bohr Del Calcio"