Cuales Son Las Limitaciones De La Teoria De Bohr
Haz clic aquí para obtener una respuesta a tu pregunta CUALES SON LAS LIMITACIONES DE LOS MODELOS ATÓMICOS DE BOHR Y DE HEISENBERG POR SEPARADO PLS 20426070160282 20426070160282 08102020. En virtud de que las masas de los átomos son del orden de 103 veces mayores que la masa de los electrones en ellos y como el átomo es eléctricamente neutro en 1900 se creía que la mayor porción de la masa átomica llevaba una carga positiva.

Repaso De Fisica Bloque Iv Manifestaciones De La Estructure Interna De La Materia Modelo De Bohr Ensenanza De Quimica Modelos Atomicos
Se especula dentro de la Física teórica que pueden existir anti neutrinos o bien que sean por momentos de una polaridad y luego otra.

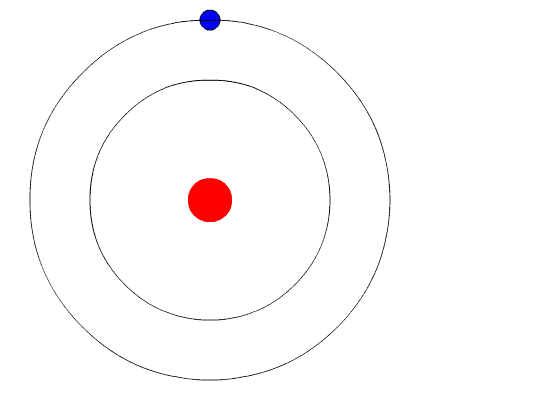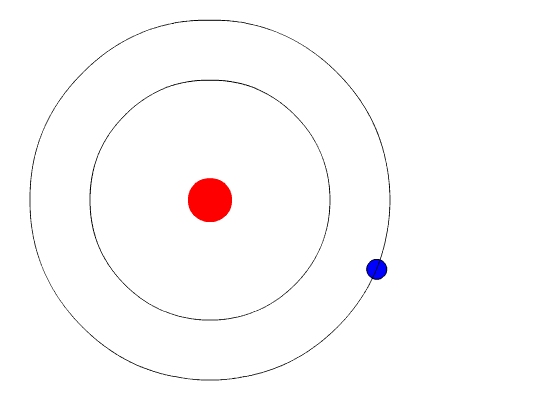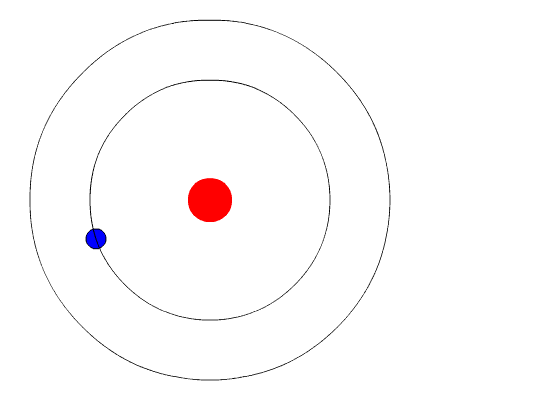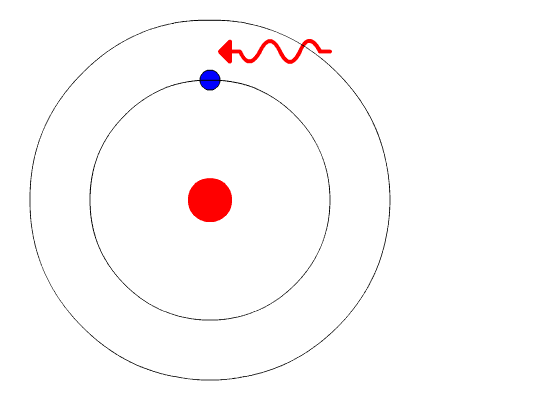
Cuales son las limitaciones de la teoria de bohr. Otro ejemplo es el Oxígeno está en el intérvalo de. Niels Bohr nacido en 1885 entró en la Universidad de Copenhague en 1903. En 1913 Niels Bohr propuso que los electrones se encuentran distribuidos en diferentes niveles energéticos.
P a Bohr es necesaria la posibilidad de contrastar las teorías con la realidad es ella la que da el veredicto final acerca de las ideas de los científicos. Limitaciones de BOHR. Hola Isabel El modelo de Bohr es limitado en términos de las predicciones en átomos con muchos electrones.
Imagen representativa de lo que sería un neutrinoSolo se trata de algo posible desde la Física de partículas pero sin evidencias concretas de su existencia. ámbito atómico amplían la experiencia al orden de las cosas que nunca son observadas de manera di recta. Fue un investigador el descubridor de los rayos anódicos.
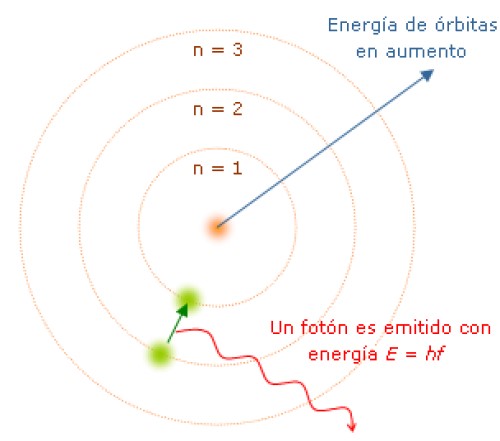
Preocupado sobre todo por las condiciones de posibilidad del conocimiento empírico. Encuentra respuesta a tu tarea ahora en Tareas Gratis. 2 2- Sólo son permitidas aquellas órbitas en las cuales el momento angular del electrón es un múltiplo entero de 2π h donde h es la constante de Planck.
El modelo más ampliamente aceptado de estructura atómica en 1900 era el modelo de Thomson. Los electrones que rodean el núcleo de un átomo pueden ser internos o externos. Hola Isabel El modelo de Bohr es limitado en términos de las predicciones en átomos con muchos electrones.
Aunque las teorías sean invenciones de los científicos siempre se necesita la. Cuales son las limitaciones del modelo de dalton. La teoría cuántica afirma que la energía viene cierta en packs discretos y que no hay valores intermedios que logren aparecer entre algunos números enteros múltiplos de la cuantía básica de energía.
Niels Henrik David Bohr fue un físico danés que realizó contribuciones fundamentales para la comprensión de la estructura del átomo y la mecánica cuántica ganó el Premio Nobel de física en 1992 La estructura electrónica de un átomo describe las energías y la disposición de los. No debemos pensar que la luz tiene al mismo tiempo naturaleza ondulatoria y corpuscular sino que para explicar su comportamiento unas veces los podemos hacer con el modelo ondulatorio y otras con el. Cuales son las limitaciones del modelo de dalton.
Segundo no puede predecir las intensidades relativas de las líneas espectrales. Cuáles son los niveles de energía de Bohr. En el capítulo anterior se estudió que los modelos atómicos de Lewis son una representación sencilla en donde primero se anota el símbolo del elemento correspondiente y posteriormente se señalan los electrones de valencia alrededor de éste así sea con puntos o con equis.
No podríamos hablar de fracasos de la teoría de Bohr pues esta teoría con todo y sus limitaciones lograba explicar cosas muy importantes como las líneas espectrales del hidrógeno y de algunos otros átomos con un solo electrón. Pero al descubrirse la existencia de las partículas subátomicas se comprobó que el átomo no era indivisible. Bohr decía estar más interesado en la filosofía que en los filósofos atraído por algunas cuestiones filosóficas que emergen en la historia de la ciencia.
Segundo no puede predecir las intensidades relativas de las líneas espectrales. Ambos tipos de electrones se encuentran en órbitas circulares alrededor del núcleo. Oponiéndose a Crookes creyó que los rayos catódicos eran a semejanza de la luz de naturaleza ondulatoria.
Según este modelo en el primer nivel energético que es el más cercano al núcleo pueden ubicarse solamente 2 electrones mientras que en el segundo nivel se pueden ubicar 8. No existe lógica sustentable sobre la existencia de un neutrino-neutro. Eugen Goldstein 5 de septiembre de 1850-26 de diciembre de 1930 fue un físico alemán.
Primero se obtienen predicciones espectrales deficientes cuando se trata de átomos con Z grandes. Las órbitas tienen un número determinado de electrones según su distancia respecto al núcleo. Según el modelo de Thomson los átomos están.
Se dedicó a investigar las descargas en los gases enrarecidos. Primero se obtienen predicciones espectrales deficientes cuando se trata de átomos con Z grandes. Dalton dijo que la materia estaba formada por átomos es decir por partículas indivisibles e inalterables.
Utilizar el modelo atómico de Bohr te contribuye a comprender como está constituido el átomo y también a argumentar la función de los electrones externos o de valencia los cuales se mueven en órbitas estables en torno al núcleo. Limitaciones del modelo atomico de bohr. A consecuencia de este orden de llenado consecutivos periodos en la Tabla periódica poseen el siguiente número de electrones en los elementos 2 8 8 18 18 32 etc.
Así se tendría que 2π n h m v r donde n es un número entero que indica la órbita o nivel energético en el que se encuentra el electrón. Tercero no puede explicar el efecto Zeeman cuando la.
Modelo Atomico De Bohr Caracteristicas Postulados Limitaciones

Quimicas El Modelo Atomico De Bohr

Isabel 3º Eso Limitaciones Del Modelo Atomico De Bohr

Modelo Atomico De Bohr Principios Errores Y Carencias Meteorologia En Red
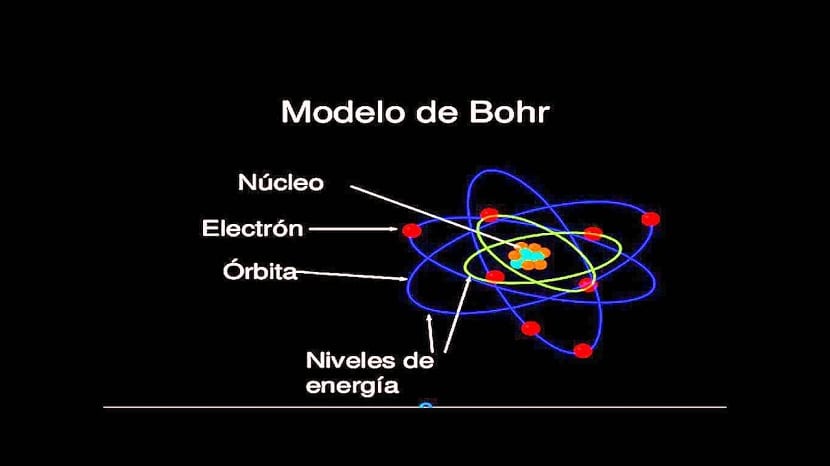
Modelo Atomico De Bohr Principios Errores Y Carencias Meteorologia En Red
Modelo Atomico De Bohr Y Limitaciones Del Modelo Atomico De By Iranzu Inigo

Modelo De Bohr Primera Aplicacion De La Mecanica Cuantica Al Atomo En 1913 Niels Bohr Consiguio Salvar El Modelo Nuclear De Rutherford Y De Paso Explicar El Espectro Discontinuo De La Luz

Modelos Atomicos Aciertos Y Errores Bohr Y Las Orbitas

Modelo Atomico De Bohr Informacion Y Caracteristicas

Modelo Atomico De Bohr Informacion Caracteristicas Y Aportes

Modelo Atomico De Bohr Principios Errores Y Carencias Meteorologia En Red
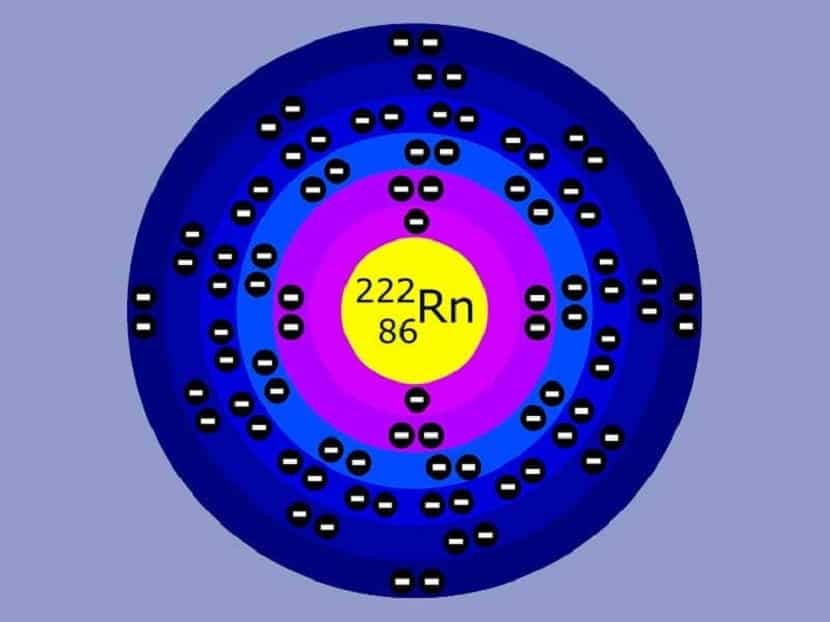
Modelo Atomico De Bohr Principios Errores Y Carencias Meteorologia En Red

Quimicas El Modelo Atomico De Bohr
Consideraciones Sobre El Modelo Del Atomo De Bohr

Isabel 3º Eso Limitaciones Del Modelo Atomico De Bohr
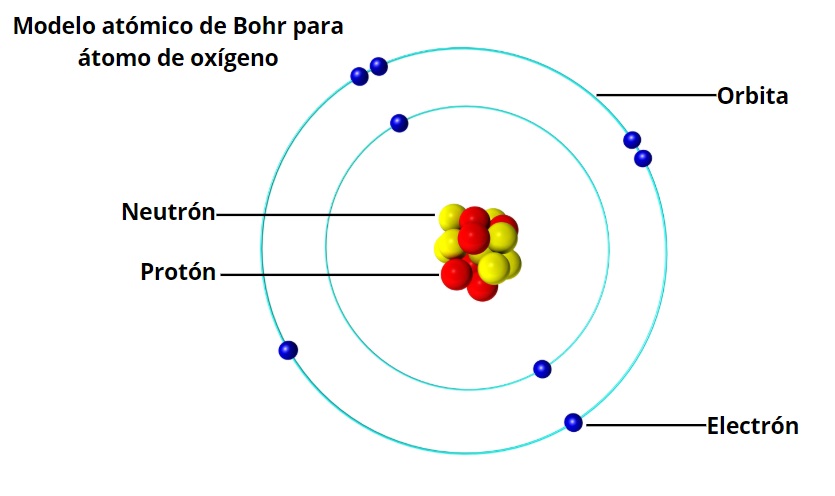
Modelo Atomico De Bohr Caracteristicas Postulados Limitaciones

Modelos Atomicos Modelos Atomicos Modelo Atomico De Bohr Notas De Quimica
Modelo Atomico De Bohr Caracteristicas Postulados Limitaciones






Posting Komentar untuk "Cuales Son Las Limitaciones De La Teoria De Bohr"