Ejemplos De La Ley De Avogadro
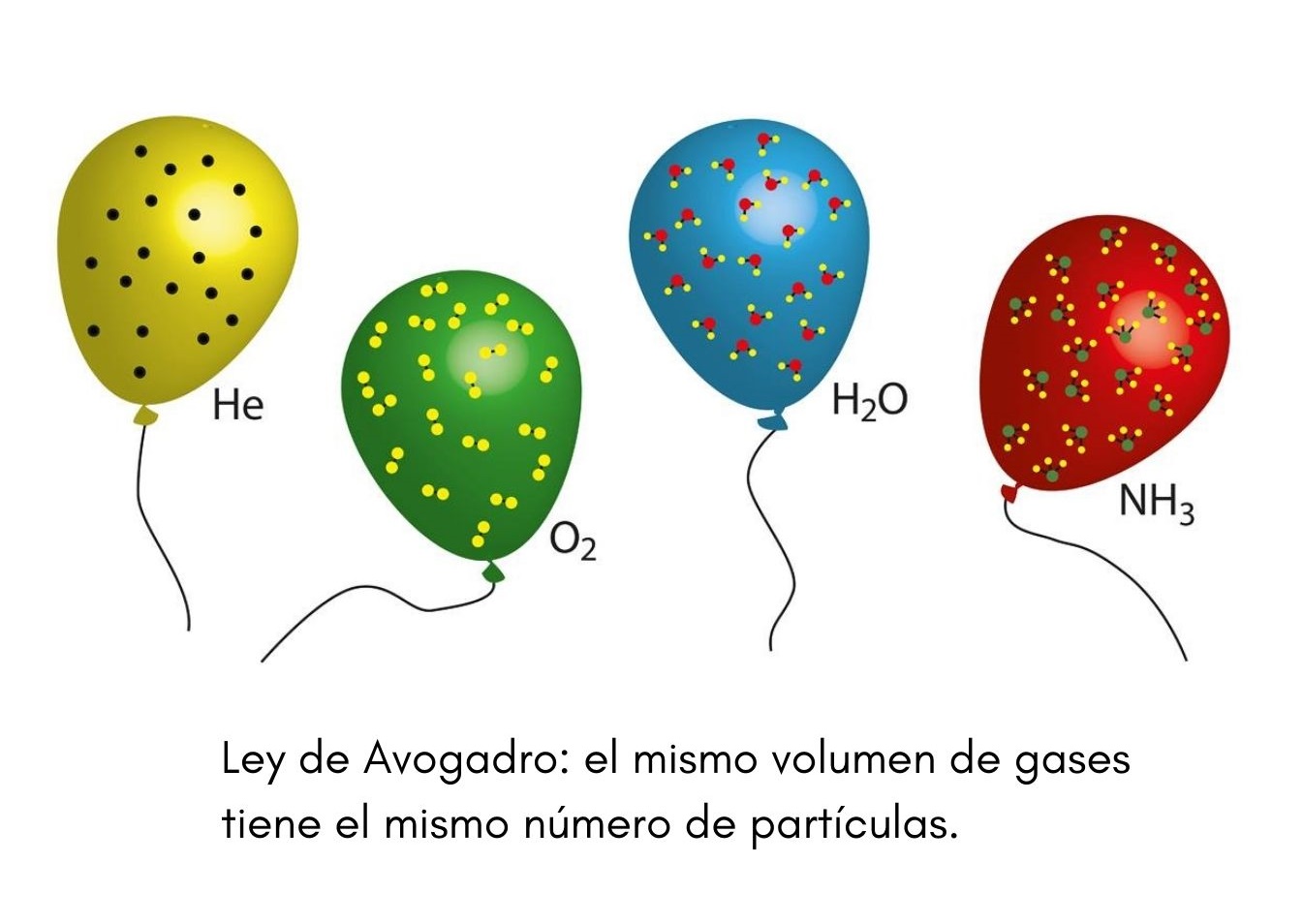
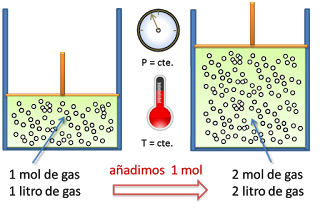
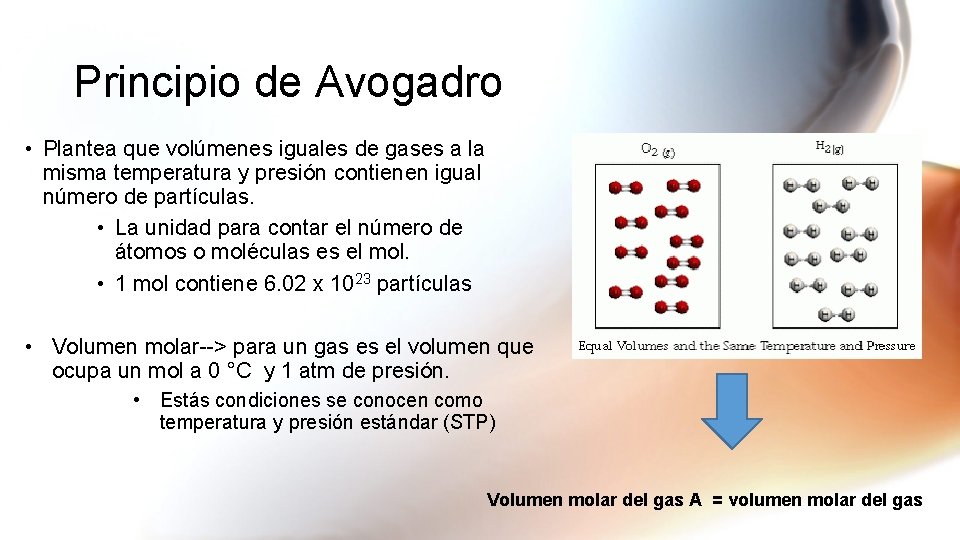
Explicación de la ley de Avogadro El trabajo del científico italiano Amadeo Avogadro complementó los estudios de Boyle Charles y Gay-Lussac. Volúmenes iguales de distintas sustancias gaseosas medidos en las mismas condiciones de presión y temperatura contienen el mismo número de moléculas.
Ejercicio amedeo avogadro introducción ley de avogadro conclusión ley de avogadro en este trabajo hablaremos sobre la ley de avogadro y resolveremos los problemas planteados Un globo de helio se infla hasta tener un volumen de 2 litros el helio es un gas muy ligero asi que poco.
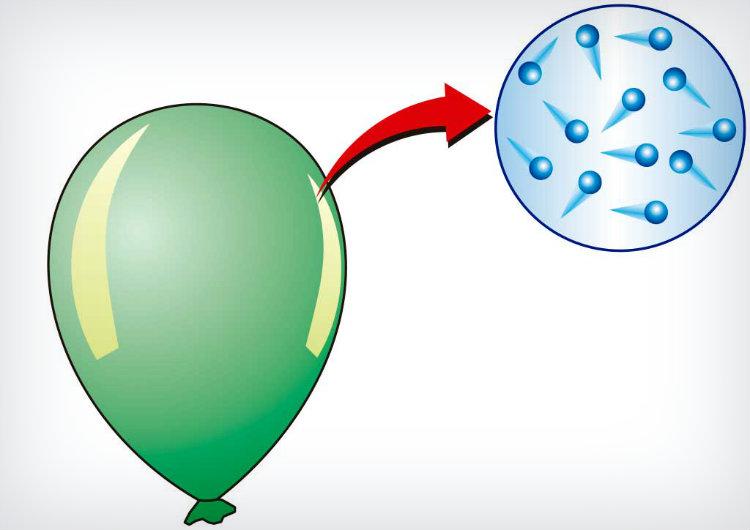
Ejemplos de la ley de avogadro. WikiMatrix La ley de Avogadro dice que. El Aire húmedo es menos denso que el aire seco. Ejemplos de la Ley de Avogadro en situaciones de la vida real.
2 2 2 2 2 198 1 44 045 045 224 1 100 gCO molCO gCO mol mol L molCO LCO En condiciones normales 1 mol de cualquier gas ocupa un volumen de 224 L posteriormente utilizando la masa molar del CO 2. Cuál es el volumen en litros que ocupan 498 g de ácido clorhídrico HCl g a T 52 C y P 11 atm. Esta ley relaciona el volumen y la cantidad numero de moles de gas a presión y temperaturas constantes.
Unidades de medición y experimento Leyes de los gases. 2 2 2 2 2 19 8 1 44 045 045 224 1 100 gCO molCO gCO mol mol L molCO LCO En condiciones normales 1 mol de cu alquier gas ocupa un volumen de 224 L posteriormente utilizando la masa molar del CO 2. Por partículas se entiende aquí moléculas o.
Ya que la ley de avogadro sugiere una relación entre los volúmenes cantidades de gas a presión y temperaturas constantes se tiene que una de sus posibles aplicaciones a la vida cotidiana entraría en el llenado de un globo infantil al suministrar gas dentro del material este se expande lo cual a su vez permite el aumento de volumen de igual forma. Ley de Avogadro Resueltos Ejercicio 1 Cuál es la masa de 100 L de CO 2 en condiciones normales de presión y temperatura CN. Ley de Avogadro Desarrollados 1- Cuál es la masa de 100 L de CO 2 en condiciones normales de presión y temperatura CN.
Por partículas se entiende aquí moléculas o átomos He Ar Ne etc. N1 0025 moles 2 l 05 l 01 moles. Cuáles son y sus fórmulas con ejemplos.
La ley de Avogadro es una de las leyes de los gases ideales. La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes. Respuesta 01 moles de helio habian.
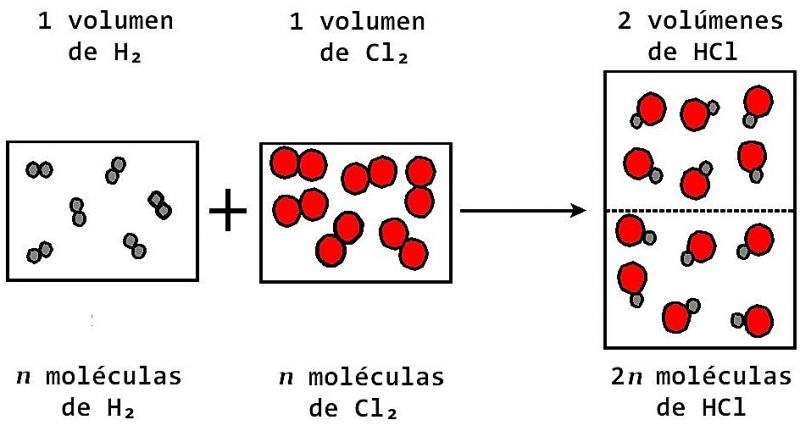
Toma el nombre de Amedeo Avogadro quien en 1811 afirmó que. Si aumentamos la cantidad de gas aumentará el volumen. En la década de 1860 Stanislao Cannizzaro refinó los pesos atómicos aplicando la ley de Avogadro en el Congreso de Karlsruhe de 1860.
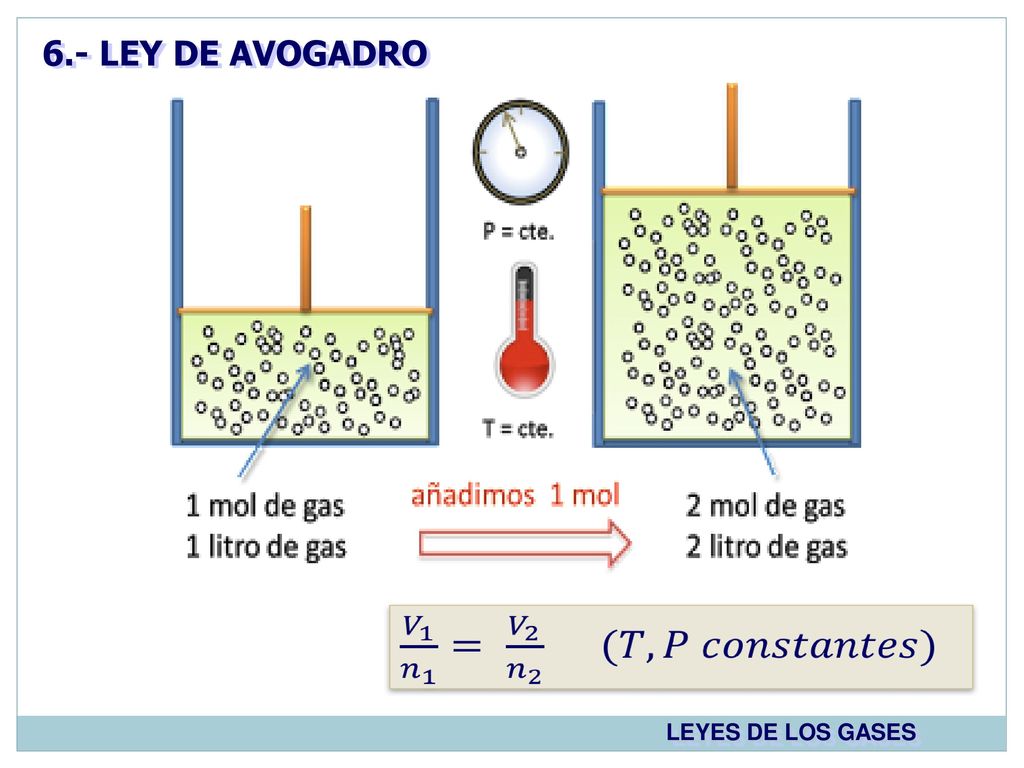
Y sugirió la hipótesis. V1n1 V2n2 n1V1 n2V2 n1 n2 V1V2. En 1811 Avogadro realiza los siguientes descubrimientos.
Esta ley descubierta por Avogadro a principios del siglo XIX establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. En la Aerodinámica y Meteorología. Toma el nombre de Amedeo Avogadro quien en 1811 afirmó que.
Un ejemplo de esta ley es cuando se inflan los globos de una fiesta y existe un aumento de los moles de aire dentro del globo así como del volumen del mismo. Recuerda que la cantidad de gas la medimos en moles. Para poder calcular el volumen que ocupa el gas de acido clorhídrico se debe conocer K para estas condiciones y el numero de moles n para esto vamos a realizar unos.
La Ley de Avogadro es la cuarta de las leyes de los gases de la que nos ocupamos. La Ley o Hipótesis de Avogadro es de gran importancia en la aerodinámica con referencia a la fuerza propulsora de los motores y del alza de las alas. Qué son tipos usos y características.
Ejemplos de la ley de avogadro en la vida cotidiana. A presión y temperatura constantes la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme. En esta unidad cuya duración es de una hora revisarás una de éstas la ley de Avogadro desde sus elementos generales hasta el proceso que se sigue cuando se aplica esta ley a un problema de impacto biológico.
La ley de Avogadro es una de las leyes de los gases ideales. Debido a que en el ejercicio anterior se mantienen constantes la presión y la temperatura y se relacionan el volumen con el numero de moles se puede emplear la ley de avogadro para solucionar este ejercicio. APLICACIONES DE LA VIDA DIARIA LEY DE LOS GASES LEY DE CHARLES LEY DE AVOGADRO LEY DE GAY-LUSSAC Cuando se le administra gas a un globo se aumenta la cantidad de gas y directamente tambien se eleva el volumen si se deja escapar un poco de gas el volumen disminuye.
Ejercicio resuelto Ley de avogadro 2. Se describe el Principio de Avogadro para los Gases Ideales la expresión matemática que enuncia la relación entre el volumen de un gas y su variación con la. Y sugirió la hipótesis.

Quimicas Ejemplos De La Ley De Graham
Ley De Avogadro Que Es Formula Condiciones Importancia Ejemplos

Que Es Ley De Avogadro Su Definicion Y Significado 2021

Ley De Avogadro Ley De Avogadro Ensenanza De Quimica El Gas
Ley De Avogadro Que Es En Que Consiste Enunciado Formula Aplicaciones

Que Significa El Numero De Avogadro Aprende En Casa Iii Secundaria Union Jalisco

Ley De Avogadro De Los Gases Quimica Wikisabio

Ley De Avogadro Leyes De Los Gases Ideales Ejercicio Resuelto Youtube

Quimicas Ley De Avogadro De Los Gases

No De Avogadro Ejercicios Youtube

Teoria Cinetica De La Materia Ley De Avogadro










Posting Komentar untuk "Ejemplos De La Ley De Avogadro"